в оглавление
назад
Иммунная система
Иммунная система защищает организм от заболеваний, своевременно идентифицируя и уничтожая различные чужеродные агенты — микроорганизмы, вирусы, инородные тела, ядовитые вещества, а также переродившиеся клетки самого организма. Существует множество способов обнаружения и избавления от таких агентов; этот процесс называется иммунным ответом. Все формы иммунного ответа можно разделить на врожденные (неспецифические) и приобретенные (специфические) реакции, лежащие в основе соответствующих видов иммунитета. Их основное различие состоит в том, что врожденный иммунитет универсален и воздействует на все антигены, а приобретенный иммунитет высокоспецифичен по отношению к конкретному антигену и позволяет эффективнее уничтожать его при повторном столкновении. Благодаря работе иммунной системы достигается биологическая индивидуальность организма.
Антигенами называют молекулы, воспринимаемые как чужеродные агенты, способные вызывать иммунный ответ в виде соответствующих антител. Организм животных, обладающих механизмами приобретенного иммунитета, производит множество разновидностей специфических иммунных клеток, которые и несут антитела, связывающие и нейтрализующие антигены. Наличие большого количества различных иммунных клеток необходимо для того, чтобы отражать атаки многочисленных возбудителей биологического происхождения, способных мутировать и изменять свой антигенный состав. Значительная часть этих клеток завершает свой жизненный цикл, так и не приняв участие в защите организма, например, не встретив подходящих антигенов. У теплокровных животных производство антител, оказывающих избирательное воздействие на конкретные антигены, дополняется повышением температуры тела, которая обеспечивает общее воздействие.
Иммунная система у позвоночных состоит из множества видов белков, клеток, органов и тканей, взаимодействия между которыми весьма сложны и динамичны. Благодаря настолько усовершенствованной иммунной реакции система со временем приспосабливается, и распознавание конкретных чужеродных веществ или клеток становится все более эффективным. С другой стороны, распознавание биологических возбудителей постоянно усложняется вследствие их адаптации и эволюционного развития новых методов успешного инфицирования организма-хозяина.
Многоэтапность иммунной защиты
Иммунная система защищает организм от инфекции в несколько этапов, при этом с каждым этапом повышается специфичность защиты. Самая простая линия защиты представляет собой физические барьеры, которые предотвращают попадание инфекции — микробов и вирусов — в организм. Если возбудитель проникает через эти барьеры, промежуточное неспецифическое воздействие на него осуществляют врожденные иммунные реакции, которые обнаруживаются практически у всех форм жизни. На случай, когда возбудители успешно преодолевают воздействие врожденных иммунных механизмов, у позвоночных имеется третий уровень защиты — приобретенные иммунные реакции. Эта часть иммунной системы адаптируется во время инфекционного процесса, чтобы улучшить распознавание чужеродного биологического материала. Такой улучшенный ответ сохраняется после уничтожения возбудителя в виде иммунологической памяти. Она позволяет механизмам приобретенного иммунитета развивать более быструю и более сильную ответную реакцию при каждом появлении такого же возбудителя.
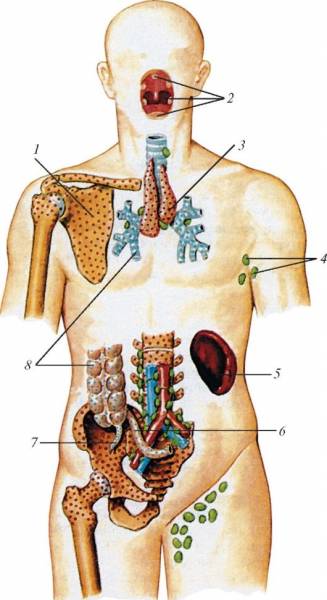
Схема расположения центральных и периферических органов иммунной системы у человека: 1 — костный мозг; 2 — миндалины лимфоидного глоточного кольца; 3 — тимус; 4 — лимфатические узлы (подмышечные); 5 — селезенка; 6 — лимфоидная (пейерова) бляшка; 7 — аппендикс; 8 — лимфоидные узелки.
Поверхностные барьеры
Организмы защищены от инфекций рядом механических, химических и биологических барьеров. Примерами механических барьеров, служащих первым этапом защиты от инфекции, могут служить кожа и слизистые оболочки. Однако организм не может быть полностью отграничен от внешней среды, поэтому существуют и другие механизмы, защищающие внешние сообщения организма — дыхательную, пищеварительную и мочеполовую системы. Эти механизмы можно разделить на постоянно действующие и включающиеся в ответ на вторжение. Пример постоянно действующего механизма — микроскопические волоски на стенках трахеи, называемые ресничками, которые совершают быстрые движения, направленные вверх, удаляя частицы пыли, пыльцу растений или другие мелкие инородные объекты, чтобы они не могли попасть в легкие. Аналогичным образом, изгнание микроорганизмов осуществляется при помощи промывного действия слез и мочи. Слизь, секретируемая в дыхательную и пищеварительную систему, также служит для связывания и обездвиживания микроорганизмов.
В случае, когда постоянно действующих механизмов оказывается недостаточно, то включаются «аварийные» механизмы очистки организма, такие как кашель, чихание, рвота и диарея.
Помимо этого, существуют химические защитные барьеры. Кожа и дыхательные пути выделяют антимикробные пептиды, например бета-дефенсины. Кроме того, кожа имеет сниженный водородный показатель из-за потовых выделений молочной и жирных кислот, препятствующий развитию микроорганизмов. Такие гидролитические ферменты, как лизоцим и фосфолипаза A, содержатся в слюне, слезах и грудном молоке, и также обладают антимикробным действием. Выделения из влагалища служат химическим барьером после начала менструаций, когда они становятся слабокислыми. Сперма содержит дефенсины и цинк для уничтожения возбудителей. В желудке соляная кислота и протеолитические ферменты служат мощными химическими защитными факторами в отношении попавших с пищей микроорганизмов.
В мочеполовом и желудочно-кишечном трактах существуют биологические барьеры, представленные дружественными микроорганизмами — комменсалами. Приспособившаяся к обитанию в этих условиях неболезнетворная микрофлора конкурирует с патогенными бактериями за пищу и пространство, и, в ряде случаев, изменяя условия обитания, в частности водородный показатель или содержание железа. Это снижает вероятность достижения болезнетворными микробами достаточных для возникновения патологии количеств.
Врожденный иммунитет
Если микроорганизму удается проникнуть через первичные барьеры, он сталкивается с клетками и механизмами системы врожденного иммунитета. Врожденная иммунная защита неспецифична, то есть ее звенья распознают и реагируют на чужеродные тела независимо от их особенностей. Эта система не создает длительной невосприимчивости к конкретной инфекции. Система врожденного иммунитета осуществляет основную защиту у большинства живых многоклеточных организмов.
Воспаление — одна из наиболее ранних реакций иммунной системы на инфекцию. К симптомам воспаления относятся покраснение и отек, что свидетельствует о усилении притока крови к вовлеченным в процесс тканям. В развитии воспалительной реакции важную роль играют эйкозаноиды и цитокины, высвобождаемые поврежденными или инфицированными клетками. К эйкозаноидам относятся лейкотриены, привлекающие определенные виды лейкоцитов, и простагландины, которые вызывают повышение температуры и расширение кровеносных сосудов. Высокая температура угнетает инфекцию. Например, возбудитель сибирской язвы прекращает размножение при температуре 41-42 °С, поэтому организмы с большей температурой тела становятся резистентными к данному заболеванию. К наиболее распространенным цитокинам относятся интерлейкины, отвечающие за взаимодействие между лейкоцитами, хемокины, стимулирующие хемотаксис, и интерфероны, обладающие противовирусными свойствами. Кроме того, могут играть роль выделяемые факторы роста и цитотоксические факторы. Эти цитокины и другие биоорганические соединения привлекают клетки иммунной системы к очагу инфекции и способствуют заживлению поврежденных тканей путем уничтожения возбудителей.
Система комплемента представляет собой биохимический каскад, который атакует мембрану чужеродных клеток. В него входят более 20 различных белков. Комплемент является основным гуморальным компонентом врожденного иммунного ответа. У млекопитающих этот механизм активируется путем связывания белков комплемента с углеводами на поверхности микробных клеток, либо путем связывания комплемента с антителами, которые прикрепились к этим микробам (второй способ отражает взаимосвязь механизмов врожденного и приобретенного иммунитета). Сигнал в виде прикрепленного к мембране клетки комплемента запускает быстрые реакции, направленные на разрушение такой клетки. Скорость этих реакций обусловлена усилением, возникающим вследствие последовательной протеолитической активации молекул комплемента, которые сами по себе являются протеазами. После того, как белки комплемента прикрепились к микроорганизму, запускается их протеолитическое действие, что, в свою очередь, активирует другие протеазы системы комплемента, и так далее. Таким образом развивается каскадная реакция, усиливающая исходный сигнал при помощи управляемой положительной обратной связи. В результате каскада образуются пептиды, привлекающие иммунные клетки, усиливающие проницаемость сосудов и опсонизирующие поверхность клетки, помечая ее «к уничтожению». Кроме того, отложение факторов комплемента на поверхности клетки может напрямую разрушать ее посредством разрушения цитоплазматической мембраны.
Существуют три пути активации комплемента: классический, лектиновый и альтернативный. За неспецифическую реакцию врожденного иммунитета без участия антител отвечают лектиновый и альтернативный пути активации комплемента. У позвоночных комплемент также участвует в реакциях специфического иммунитета, при этом его активация обычно происходит по классическому пути.




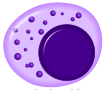
Клетки неспецифического иммунитета, слева направо: нейтрофил, моноцит, макрофаг, эозинофил, натуральный киллер.
Главным клеточным звеном иммунного ответа в первую очередь являются лейкоциты, или белые кровяные тельца. Они распознают и уничтожают чужеродные частицы путем фагоцитоза, из-за чего также именуются фагоцитами, либо, в случае крупных чужеродных тел (например, паразитов или крупных опухолевых клеток), путем выделения разрушительных частиц при непосредственном контакте. Данная функция основывается на простых механизмах распознавания, позволяющих связывать самые разнообразные микробные продукты, и относится к проявлениям врожденного иммунитета. С появлением специфического иммунного ответа мононуклеарные фагоциты начинают играть важную роль в его механизмах путем представления антигенов T-лимфоцитам. Для эффективного уничтожения микробов фагоцитам требуется активация.
Обычно фагоциты циркулируют по организму в поисках чужеродных материалов, но могут быть призваны в определенное место при помощи цитокинов. После поглощения чужеродного микроорганизма фагоцитом он оказывается в ловушке внутриклеточного пузырька, который называется фагосомой. Фагосома сливается с другим пузырьком — лизосомой, в результате чего формируется фаголизосома. Микроорганизм погибает под воздействием пищеварительных ферментов (например, лизоцима), либо в результате дыхательного взрыва, при котором в фаголизосому высвобождаются кислородные радикалы, оксиданты (например, пероксид водорода) и оксид азота. Фагоцитоз эволюционировал из способа получения захвата питательных веществ, но эта роль у фагоцитов была расширена, став защитным механизмом, направленным на разрушение патогенных возбудителей.
К фагоцитам относятся такие клетки, как мононуклеарные фагоциты (в частности — моноциты и макрофаги), нейтрофилы и дендритные клетки. Макрофаги и нейтрофилы ведут поиск проникших сквозь первичные барьеры чужеродных микроорганизмов. Макрофаги происходят от моноцитов, мигрирующих в ткани; некоторые макрофаги сохраняют мобильность (свободные макрофаги), тогда как другие ограничены некоторой областью (фиксированные макрофаги). Фиксированные макрофаги находятся, например, в клетках Купфера в печени, клетках Лангерганса в коже, в синусе селезенки, в лимфоузлах и т. д. Макрофаги представляют собой клетки многоцелевого назначения, обитающие в тканях и производящие широкий спектр биохимических факторов, включая ферменты, белки системы комплемента и регуляторные факторы, например интерлейкин-1. Кроме того, макрофаги выполняют роль уборщиков, избавляя организм от изношенных клеток и другого мусора, а также роль антиген-презентирующих клеток, активирующих звенья приобретенного иммунитета. Нейтрофилы обычно обнаруживаются в крови и представляют собой наиболее многочисленную группу фагоцитов, обычно представляющую около 50-60 % общего количества циркулирующих лейкоцитов. Во время острой фазы воспаления, в частности, в результате бактериальной инфекции, нейтрофилы мигрируют к очагу воспаления. Этот процесс называется хемотаксисом. Они обычно являются первыми клетками, реагирующими на очаг инфекции.
Дендритные клетки представляют собой фагоциты в тканях, которые соприкасаются с внешней средой, т. е. расположены они, главным образом, в коже, носу, легких, желудке и кишечнике. Они названы так, поскольку напоминают дендриты нейронов наличием многочисленных отростков, однако дендритные клетки никоим образом не связаны с нервной системой. Дендритные клетки служат связующим звеном между врожденным и приобретенным иммунитетом, поскольку они представляют антиген T-клеткам, одному из ключевых типов клеток приобретенного иммунитета.
Вспомогательными клетками считаются тучные клетки, базофилы, эозинофилы и тромбоциты. Также в иммунной защите участвуют соматические клетки различных тканей организма. Тучные клетки находятся в соединительной ткани и слизистых оболочках и участвуют в регуляции воспалительной реакции. Они очень часто связаны с аллергией и анафилаксией. Эти клетки во многом напоминают базофилы — одну из малочисленных подгрупп зернистых лейкоцитов. Базофилы и эозинофилы родственны нейтрофилам. Эозинофилы секретируют биохимические медиаторы, которые участвуют в защите от крупных многоклеточных паразитов, а также играют роль в аллергических реакциях, например при бронхиальной астме.
Натуральные, или естественные, киллеры представляют собой большие гранулярные лимфоциты, лишенные признаков Т- или В-лимфоцитов, которые специализируется на неспецифической защите против вирусов, микобактерий, опухолевых клеток и т. д. Они закрепляются к опсонизированным поверхностным антигенам и с помощью специальных агентов (перфоринов) формируют поры в стенках клеток-мишеней, тем самым способствуя их дальнейшему лизису. Таким образом, натуральные киллеры находятся на стыке неспецифического и специфического иммунитета.
При неспецифических иммунных реакциях, в отличие от специфических, не происходит увеличения численности специальных клеток, ориентированных на защиту от конкретного антигена, поэтому неспецифические защитные механизмы также называют неклональными.
Приобретенный иммунитет
Система приобретенного иммунитета впервые появляется у низших позвоночных. Она требует распознавания специфических чужих («не своих») антигенов в процессе, называемом презентацией антигена. Специфичность антигена позволяет осуществлять реакции, которые предназначены конкретным микроорганизмам или инфицированным ими клеткам. В результате работы системы приобретенного иммунитета реализуется более интенсивный иммунный ответ, а также иммунологическая память, благодаря которой каждый чужеродный микроорганизм «запоминается» по уникальным для него антигенам. Специфический иммунитет можно подразделить на клеточный и гуморальный.

Клетки приобретенного иммунитета: Т-лимфоцит (слева) и В-лимфоцит (справа).
Клетки иммунной системы, на которые возложены ключевые функции по осуществлению приобретенного иммунитета, относятся к лимфоцитам, которые являются подтипом лейкоцитов. Большая часть лимфоцитов отвечает за специфический приобретенный иммунитет, так как могут распознавать возбудителей инфекции внутри или вне клеток, в тканях или в крови.
В организме предшественники лимфоцитов непрерывно продуцируются в ходе дифференциации стволовых кроветворных клеток, при этом вследствие мутаций генов, кодирующих вариабельные цепи антител, возникает множество клеток, чувствительных к множеству потенциально существующих антигенов. На этапе развития лимфоциты проходят отбор: остаются только значимые с точки зрения защиты организма, а также те, которые не несут угрозы собственным тканям. Параллельно с этим процессом лимфоциты разделяются на группы, способные выполнять ту или иную функцию защиты. Существуют разные виды лимфоцитов. В частности, по морфологическим признакам их разделяют на малые лимфоциты и большие гранулярные лимфоциты.
В зависимости от структуры внешних рецепторов лимфоциты разделяются на различные типы. Основными типами являются B-клетки и T-клетки, происходящие из плюрипотентных гемопоэтических стволовых клеток. У взрослых млекопитающих они образуются в костном мозге (по этой функции он аналогичен фабрициевой сумке птиц), причем T-лимфоциты вскоре мигрируют в тимус (вилочковую железу). В связи с этим костный мозг и тимус называют первичными лимфоидными органами. Здесь клеточная пролиферация и дифференциация продолжается. В процессе созревания Т-лимфоциты контактируют со специализированными эпителиальными клетками, дендритными клетками и макрофагами, что дает возможности для отбора Т-клеток, нужных иммунной системе в этот момент. Важную роль в созревании Т-клеток играют цитокины и интерлейкины 1, 2, 6 и 7. В ходе созревания многие лимфоциты, особенно направленные на распознавание белков самого организма, подвергаются разрушению. Созревание В-клеток также зависит от цитокинов и интерлейкинов 1, 6, 7.
Зрелые Т- и В-лимфоциты покидают места своего созревания и мигрируют во вторичные лимфоидные органы: селезенку, лимфатические узлы, а также лимфоидную ткань слизистых оболочек. Она представляет собой скопления лимфоидных клеток, расположенные под слизистой желудочно-кишечного тракта, дыхательных путей, мочевыводящих путей, слезных желез. Кроме того, по всему телу беспорядочно разбросаны лимфатические клетки, иногда организованные в крупные скопления, например, миндалины или пейеровы бляшки. Как Т-, так и В-клетки несут на своей поверхности рецепторные молекулы, которые распознают специфические мишени. Рецепторы представляют из себя как бы «зеркальный отпечаток» определенной части чужеродной молекулы, способный присоединяться к ней. При этом одна клетка может содержать рецепторы только для одного вида антигенов.
T-клетки отвечают за клеточно-опосредованный специфический иммунный ответ. Он требует участия специализированных антигенпрезентирующих клеток, которыми могут выступать дендритные клетки, макрофаги и В-клетки. В антигенпрезентирующей клетке фрагмент антигена связывается с собственной молекулой главного комплекса гистосовместимости, и образовавшийся комплекс выставляется на поверхность клетки, становясь доступным для распознавания Т-клетками. После распознавания антигена Т-клетка начинает выделять интерлейкин 2, который стимулирует клональную экспансию этих моноспецифических Т-клеток.
В ходе клональной экспансии Т-клетки дифференцируются на Т-киллеры, Т-хелперы I-го типа и Т-хелперы II-го типа. T-киллеры распознают только антигены, которые объединены с молекулами главного комплекса гистосовместимости I-го класса, в то время как T-хелперы распознают только антигены, расположенные на поверхности клеток в сочетании с молекулами главного комплекса гистосовместимости II-го класса. Это различие в презентации антигена отражает разные роли указанных двух типов T-клеток. Другим, менее распространенным типом T-клеток, являются γδ T-клетки, которые распознают неизмененные антигены, не связанные с рецепторами главного комплекса гистосовместимости.
Круг задач T-лимфоцитов весьма широк. Т-киллеры убивают инфицированные клетки собственного организма при помощи токсичных белков (цитокинов), действуя специфически при непосредственном контакте. Т-хелперы I-го типа активируют макрофаги и запускают воспалительный процесс для более эффективного разрушения микроорганизмов. Т-хелперы II-го типа активируют В-клетки для образования антител, действие которых направлено прежде всего против внеклеточно расположенных возбудителей.
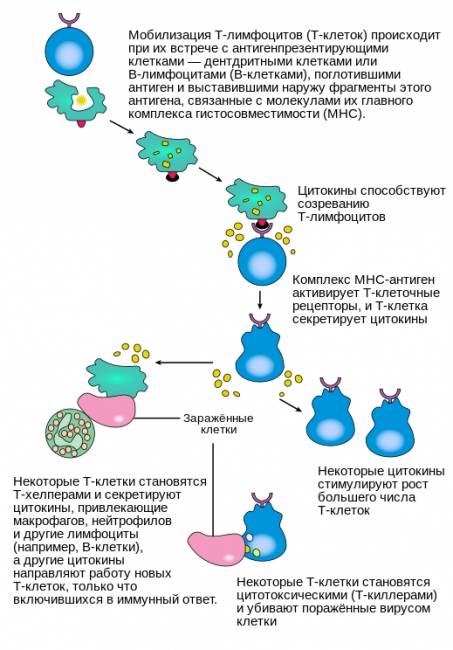
Механизм активации Т-лимфоцитов.
Гуморальная специфическая иммунная реакция осуществляется В-клетками. Активация их начинается с того, что с многочисленными мономерами иммуноглобулинов IgM и IgD, прикрепленными к поверхности В-клеток, связывается соответствующий антиген. Однако одного образования поверхностного комплекса антиген-антитело недостаточно; для активации необходим второй сигнал, который может поступать либо от тимуснезависимого антигена (например, бактериального полисахарида), либо тимусзависимого (от Т-хелперов II-го типа). В последнем случае В-клетка передает антиген Т-хелперу. Если Т-хелпер распознает этот антиген, то он начинает выделять интерлейкин 4, который стимулирует клональную селекцию специфических В-клеток, которые, дифференцируясь в плазмоциты, производят антитела (иммуноглобулины, Ig) против этого антигена. Механизм действия образуемых антител на чужеродный агент может быть различным. Они могут связывать поверхностные антигены вируса и блокировать его способность к инфицированию других клеток (нейтрализация вирусной частицы), могут связываться с поверхностными антигенами на поверхности бактерии и привлекать к ней макрофагов, запуская фагоцитоз (уже упоминавшаяся опсонизация). Антитела могут также связывать антигены на поверхности бактериальной клетки, а с антителами связывается система комплемента, белок которого образует поры в мембране бактериальной клетке, тем самым убивая ее. Выделяют 5 классов антител: IgG — основной класс антител крови; IgM — первые антитела, продуцируемые при развитии иммунного ответа; IgA — основной класс антител, содержащихся в молоке, слизи, слезах, секретах дыхательных путей и кишечника; IgD — функционируют как рецепторы клеточных мембран; IgE — осуществляют защиту от паразитов, обусловливают развитие аллергических реакций.
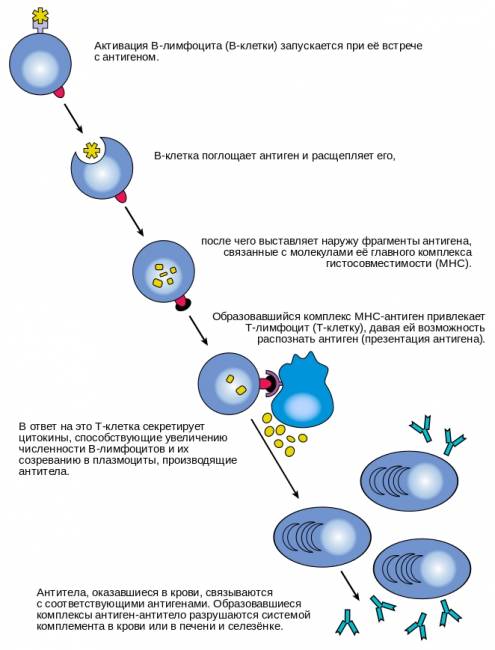
Механизм активации В-лимфоцитов.
При столкновении с антигеном образуются также Т- и В-клетки памяти, которые могут при повторном столкновении с этим антигеном быстро дифференцироваться соответственно в Т-киллеры или плазмоциты и начать производить антитела. Кроме того, существуют лимфоциты, проявляющие неспецифическую цитотоксичность — уже упомянутые натуральные киллеры.
Несмотря на общее сходство, даже между близкими биологическими видами наблюдаются различия на уровне иммунных тканей, клеток и растворимых медиаторов. Особенно заметны различия на уровне семейств генов, чьи представители характеризуются большой сложностью и полиморфизмом — например, генов, кодирующих антитела, Т-клеточные рецепторы, главный комплекс гистосовместимости, а также рецепторы натуральных киллеров.
Иммунологическая память
Иммунологическая память — это способность иммунной системы более быстро и эффективно отвечать на антиген (патоген), с которым у организма уже был предварительный контакт. Данное явление обеспечивается предсуществующими антигенспецифическими клонами как В-, так и Т-клеток, которые функционально более активны в результате прошедшей первичной адаптации к определенному антигену (приобретенный иммунитет). Пока неясно, устанавливается ли память в результате формирования долгоживущих специализированных клеток памяти или же память отражает собой процесс рестимуляции лимфоцитов постоянно присутствующим антигеном, попавшим в организм при первичной иммунизации. Так или иначе, если макроорганизм инфицируется микроорганизмом более одного раза, клетки иммунной системы используются для быстрого уничтожения такого микроорганизма.
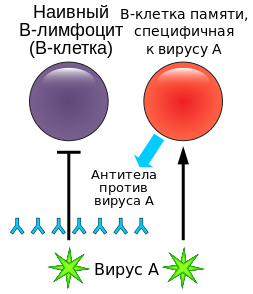
Механизм работы В-клеток памяти.
Аллергия
Аллергия (реакция гиперчувствительности) представляет собой специфический преувеличенный иммунный ответ на чужеродное (обычно безвредное) вещество или антиген (антигены, вызывающие аллергию, называют аллергенами). При первом контакте с антигеном происходит сенсибилизация (аллергизация), а при последующих контактах происходит разрушение здоровых клеток и интактных тканей из-за воспалительных реакций. Наиболее распространены аллергические реакции, образуемыми в ответ на антиген антителами IgE, которые активно связываются с тучными клетками. В результате тучные клетки быстро высвобождают наиболее активные медиаторы воспаления (гистамин, лейкотриены и др.), в результате чего в течение нескольких минут развивается иммунная реакция (анафилаксия). Из-за быстроты развития реакции этот тип аллергических реакций получил название гиперчувствительности немедленного типа.
Иммунологическая толерантность при беременности
При беременности у самок эвтериев наблюдается иммунологическая толерантность по отношению к плаценте и развивающемуся плоду. Это явление можно рассматривать как пример необычно успешной аллотрансплантации, поскольку плод и плацента генетически отличаются от организма матери. При этом следует иметь в виду, что при беременности подавляются два иммунных ответа: местный иммунный ответ на плаценту со стороны матки и системный ответ на клетки зародыша со стороны всего материнского организма. Существует множество механизмов, обусловливающих этот «иммунологический парадокс» беременности. Некоторые из них являются плацентарными механизмами, то есть обеспечивают функционирование плаценты как иммунологический барьер между матерью и плодом, создавая иммунологически привилегированную зону. Существует также гипотеза фетоэмбрионической защитной системы эвтериев, согласно которой растворенные в цитоплазме и заякоренные в мембране гликопротеины, экспрессирующиеся в гаметах, подавляют любой иммунный ответ на плод или плаценту. Тем не менее, многие случаи спонтанных абортов обусловлены именно иммунным ответом организма матери на плод. Другим примером, демонстрирующим недостаточность иммунологической толерантности при беременности, является резус-конфликт; кроме того, одной из причин преэклампсии является ненормальный иммунный ответ матери на плаценту.
вперед
в оглавление